|
一次性使用无菌手术包类产品注册临床试验要求:
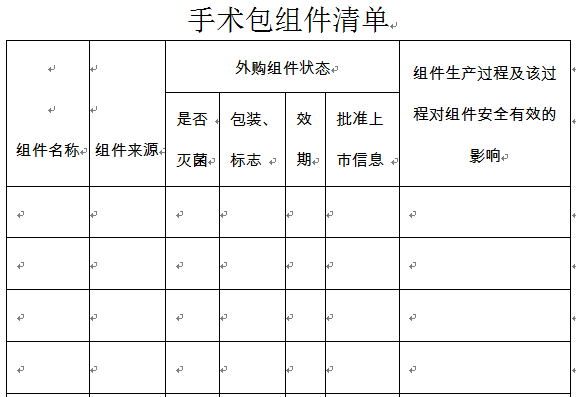
一次性使用无菌手术包产品的临床试验要求应以其中的组件组成情况来确定,一般分两种情况。
若手术包中的二类医疗器械组件均在《豁免提交临床试验资料的第二类医疗器械目录(试行)》范围内,生产企业在申报以上组件的手术包时,可以书面申请免于提交临床试验资料,但应同时提交申报产品与已上市同类产品的对比说明。对比说明应当包括产品材质、结构组成、主要技术性能指标、灭菌方法、预期用途等内容。
若手术包中的二类医疗器械组件有不在《豁免提交临床试验资料的第二类医疗器械目录(试行)》范围内,则手术包需要按照《医疗器械注册管理办法》中的相关规定提交临床试验资料。
本文来源于 :医疗器械临床试验 临床试验 代理 http://www.hongyuanyixiezixun.com
|