|
腔镜用吻合器产品的医疗器械注册申报资料要求:
(一)综述资料
医疗器械注册证代办
1.概述
产品名称依据《医疗器械通用名称命名规则》确定。根据吻合后钉的排列形状,可命名为腔镜用直线型吻合器、腔镜用管型吻合器、腔镜用弧线型吻合器等,若同时有切割功能,名称中可带有“切割”字样,根据吻合器器身是一次性使用或可重复使用,产品名称中可带有“一次性”或“可重复使用”字样。如:产品名称可为一次性腔镜用直线型吻合器、一次性腔镜用直线型切割吻合器。
2.产品描述
医疗器械注册产品描述应全面、详细,至少应包括申报产品名称、结构组成(含配合使用的附件)、工作原理、主要原材料、性能、预期用途、适用的解剖部位,以及区别于其他同类产品的特征等内容。必要时提供图示说明。
(1)结构组成
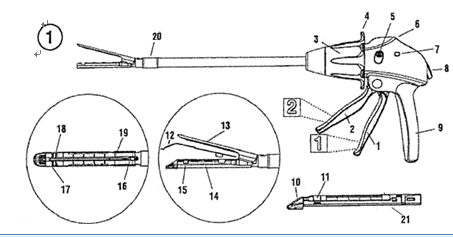
通常情况下一套完整的腔镜用吻合器(以下简称“吻合器”)最基本组成是器身和组件;器身由手柄、保险装置、旋转环、关节旋钮、钉砧(又名抵钉座)和钉砧释放钮等组成。吻合器中可更换部分通常称为组件,组件一般包括钉仓(钉匣)、吻合钉和推钉片。根据产品设计不同,切割刀可装配于器身或组件。
(2)工作原理
吻合器通过机械传动装置,将预先放置在组件中呈两排或数排互相平行错位排列的吻合钉,击入已经对合好需要吻合在一起的组织内,吻合钉在穿过组织后受到前方钉砧阻挡,向内弯曲,形成类“B”形互相错位排列,将组织吻合在一起。由于小血管可以从“B”形吻合钉空隙中通过,故不影响吻合部位及其远端的血液供应。
3.型号规格
对于存在多种型号规格的产品,说明型号规格的划分依据、明确各型号规格的区别。可采用对比表或带有说明性文字的图片、图表,对不同型号规格的结构组成、性能指标加以描述。
4.包装说明
有关产品包装的信息,以及与该产品一起销售的配件包装情况。说明与灭菌方法相适应的最初包装的信息。
5.产品适用范围和禁忌症
(1)适用范围:应当明确产品的适用范围,包括预期应用的解剖部位、配合使用的器械(如适用)。
(2)适用人群:目标患者人群的信息(如成人、儿童),患者选择标准的信息。
(3)禁忌症:如适用,应当明确说明该产品禁忌应用的特定人群、疾病种类等。
6.参考的同类产品或前代产品情况
应当提供同类产品(国内外已上市)或前代产品(如有)的信息,阐述申请医疗器械注册产品的研发背景和目的。对于同类产品,应当说明选择其作为研发参考的原因。
申请人应综述该类产品国内外研究及临床使用现状。列表比较说明本次申报产品与已上市同类及前代产品(如有)的相同点和不同点,比较的项目应包括工作原理、结构组成、原材料、性能指标、适用范围、生产工艺、灭菌方式、有效期、已上市国家等。
吻合器及吻合钉的材料应符合行业标准YY0875-2013《直线型吻合器及组件》(本指导原则中标准适用最新版本,下同)、YY 0876-2013《直线型切割吻合器及组件》中对原材料的规定。
明确产品全部原材料、供应商、符合的标准等基本信息,建议以列表的形式提供。说明原材料的选择依据及来源。原材料应具有稳定的供货渠道以保证产品质量,需提供原材料生产厂家的资质证明及外购协议。应明确所用原材料的质控标准及生产过程中的检验步骤,提交原材料符合相应标准的全性能验证报告。
对于首次应用于医疗器械的新材料,应提供该材料适合用于人体预期使用部位的相关研究资料。
医疗器械产品注册腔镜用吻合器产品技术要求:
医疗器械注册申请人应结合产品的技术特征和临床使用情况来确定产品安全有效、质量可控的技术要求与检验方法。产品技术要求中应包括产品的一般信息(结构组成、示意图、原材料、灭菌方法、有效期、初包装信息)、规格型号及其划分的说明、产品性能指标及试验方法。产品技术要求中的内容引用国家标准、行业标准、中国药典或国际标准的,应保证其有效性,并注明相应标准的编号、年号及中国药典的版本号。制定吻合器技术要求的常用参考标准见上述产品性能研究章节。
医疗器注册代理吻合器性能要求一般应包括如下项目:
1.外观
参考YY 0875中相关要求制定。
2.尺寸(吻合长度、吻合钉高度)
3.吻合钉材料
应符合YY 0875中的相关规定。
4.灵活性、装配性
参考YY 0875、YY 0876中相关要求制定。
5.吻合和/或切割性能、吻合口耐压性能、切割刀锋利度
参考YY 0875、YY 0876中相关要求制定。
6.击发后听觉/触觉等反馈
7.硬度要求
重复使用吻合器的抵钉座硬度应不低于35HRC。
医疗器械注册证申请人也可根据自己产品的性能制定关键部件的硬度要求,但需要提供完整的验证资料予以证明。
8.表面粗糙度
吻合器金属外表面粗糙度Ra应不大于0.8μm。
9.耐腐蚀性能
重复性使用吻合器切割刀、抵钉座的耐腐蚀性能应符合
YY/T 0149中5.4 b级的规定。
10.安全/保护装置
吻合器应具有安全保护装置,如防止空钉仓击发的保护
装置。
11.吻合器器身与组件的连接牢固度
12.包装密封
参考YY 0875制定。
13.灭菌
14.环氧乙烷残留量
15.吻合器附件性能(若有)
16.化学性能(若适用)
医疗器械产品注册技术要求中的性能指标不应低于相关行业标准(如YY 0875、YY 0876)中的适用条款的相关要求,检验方法应采用行业标准中的方法,若采用其他方法则应选择经验证的方法并说明原因。
对宣称的所有其他技术参数和功能,均应在产品技术要求中予以规定。
医疗器械产品注册技术要求的编制说明应说明产品性能指标及试验方法制订的依据。
本文来源于:医疗器械注册 医疗器械注册代理
|