|
|
| |
|
境内创新医疗器械注册特别审批申请的初审指南咨询
|
|
| [
2016-03-23 16:04 ] |
|
|
|
106-012 境内创新医疗器械注册特别审批申请的初审
一、办理要素
(一)事项名称和编码:境内创新医疗器械特别审批申请的初审
(二)受理范围
1.申请人:广东省内持有合法证照企业
2.申请内容:境内创新医疗器械特别审批申请的初审
3.申请条件:
a.企业注册地在广东省内;
b.符合食药监械管[2014]13号文中第二条要求,且能提供食药监械管[2014]13号文中第四条材料的。
(三)受理地点
地址:广州市东风东路753号之二;交通指引:附近公交站:东峻广场站、动物园南门站;附近地铁站:杨箕站、动物园站;
地图:

(四)办理依据
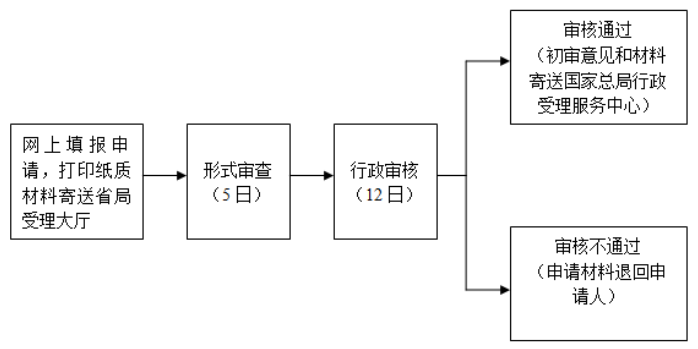
《关于印发创新医疗器械特别审批程序(试行)的通知》食药监械管[2014]13号第五条境内申请人应当向其所在地的省级食品药品监督管理部门提出创新医疗器械特别审批申请。省级食品药品监督管理部门对申报项目是否符合本程序第二条要求进行初审,并于20个工作日内出具初审意见。经初审不符合第二条要求的,省级食品药品监督管理部门应当通知申请人;符合第二条要求的,省级食品药品监督管理部门将申报资料和初审意见一并报送国家食品药品监督管理总局行政受理服务中心。
(五)实施机关
1.实施机关的名称:广东省食品药品监督管理局
2.实施机关的权限:境内创新医疗器械认定初审
3.实施机关的类别:行政机关
(六)办件类型:
出具初审意见加盖公章
(七)出具意见条件
1.予以出具意见的条件:
(1)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(2)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
2.不予出具意见的情形:
(1)专利文件不全,专利人和专利内容与项目不符或不是核心技术。
(2)产品主要工作原理/作用机理不属于国内首创,产品性能或者安全性与同类产品比较没有根本性改进,技术上不属于国际领先水平,缺乏显著的临床应用价值支持性资料。
(3)产品没有定型,查新报告不合格等。
不符合上述条件之一的,不予出具意见。
3.出具意见数量限制:无限制。
(八)申请材料
1.申请材料目录
(1)创新医疗器械特别审批申请表;
(2)申请人企业法人资格证明文件;
(3)产品知识产权情况及证明文件;
(4)产品研发过程及结果的综述;
(5)产品技术文件,至少应当包括:
a.产品的预期用途;
b.产品工作原理/作用机理;
c.产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(6)产品创新的证明性文件,至少应当包括:
a.信息或者专利检索机构出具的查新报告;
b.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
c.国内外已上市同类产品应用情况的分析及对比(如有);
d.产品的创新内容及在临床应用的显著价值。
(7)产品安全风险管理报告;
(8)产品说明书(样稿);
(9)其他证明产品符合食药监械管[2014]13号第二条的资料;
(10)所提交资料真实性的自我保证声明。
申报资料应当使用中文,原文为外文的,应当有中文译本。
2.材料要求
(1)申请材料应清晰、整洁,使用A4规格纸张打印;
(2)每项文件第一页作标签,或用带标签的隔页纸分隔,并按申请材料一级目录标明项目编号;
(3)每项文件均应加盖企业公章;
(4)按照申请材料目录的顺序装订成册;
(5)用档案袋将报送的材料装好,档案袋需使用封面,格式见“档案袋封面格式”。
(6)封装好的申请资料要求以邮寄的方式寄到(或现场送达)广东省食品药品监督管理局
(地址:广州市东风东路753号之二业务受理处,)。
3.申请表格及文件下载
在国家总局网上办事平台中“医疗器械注册管理信息系统”填报,并打印出带有条码的申请书。
(九)办理时限
(1)申请时限:无
(2)法定办理时限:《创新医疗器械特别审批程序(试行)》第五条 境内申请人应当向其所在地的省级食品药品监督管理部门提出创新医疗器械特别审批申请。省级食品药品监督管理部门对申报项目是否符合本程序第二条要求进行初审,并于20个工作日内出具初审意见。经初审不符合第二条要求的,省级食品药品监督管理部门应当通知申请人;符合第二条要求的,省级食品药品监督管理部门将申报资料和初审意见一并报送国家食品药品监督管理总局行政受理服务中心。
(3)承诺办理时限:12个工作日
(十)初审收费
不收费。
(十一)申请人权利和义务
1.申请人依法享有以下权利:
(1)对于经审查同意按本程序审批的创新医疗器械,申请人所在地食品药品监督管理部门应当指定专人,应申请人的要求及时沟通、提供指导。在接到申请人注册质量管理体系核查申请后,应当予以优先安排。
(2)对于创新医疗器械,医疗器械检测机构在进行注册检测时,应当对生产企业提交的注册产品标准优先进行预评价,对存在问题的,应当及时向生产企业提出修改建议。
(3)医疗器械检测机构应当在接受样品后优先进行医疗器械产品注册检测,并出具检测报告。
2.申请人依法履行以下义务:
(1)申请人应按照程序提交申请材料。
(2)申请人应对其申请材料实质内容的真实性负责。
二、咨询
(一)咨询途径:
1.窗口咨询。地址:广州市东风东路753号之二1楼受理大厅
2.电话咨询。37886014(受理),或咨询省局医疗器械注册处
3.网上咨询。
4.信函咨询。咨询部门名称:广东省食品药品监督管理局医疗器械注册处;通讯地址:广州市东风东路753号之二;邮政编码:510080
(二)咨询回复
1.咨询回复方式:按实际咨询方式,采取电话、信函、电子邮件、网上等相应方式回复。
2.负责回复的内部机构:医疗器械注册处。
3.回复时限:15个工作日
三、办理流程
(一)创新医疗器械注册办理流程图
(网上申报流程)
申报人必须通过我局的企业网上办事平台),或者省政府网上办事大厅进行网上申报,如需补充纸质材料,按国家总局要求应在总局网上办事平台中“医疗器械注册管理信息系统”填报,打印出带有条码的申请书,请于网上申报完成后5个工作日内寄达省局业务受理处,或抵达省局业务受理处进行递交。

(受理大厅申报流程)
申报人必须通过我局的企业网上办事平台或者省政府网上办事大厅进行网上申报,如需补充纸质材料,按国家总局要求应在总局网上办事平台中“医疗器械注册管理信息系统”填报,打印出带有条码的申请书,请于网上申报完成后5个工作日内寄达省局业务受理处,或抵达省局业务受理处进行递交。
(二)申请
(1)申报人必须通过我局的企业网上办事平台,或者省政府网上办事大厅,进行网上申报,如需补充纸质材料,按国家总局要求应在总局网上办事平台中“医疗器械注册管理信息系统”填报,打印出带有条码的申请书,请于网上申报完成后5个工作日内寄达省局业务受理处,或抵达省局业务受理处进行递交。
(2)接受部门:广东省食品药品监督管理局业务受理处。
接收地址:广州市东风东路753号之二1楼受理大厅。
(3)网上申报不限时间,业务受理处办公时间:每周一至周五上午9:00-12:00,下午13:00-17:00(逢周五下午不对外办公)
(三)受理
受理大厅自收到材料5个工作日内受理
(四)办理进度查询
申请人可电话查询办理情况
(五)办理结果
通过广东省食品药品监督管理局初审的,省局将出具初审意见并连同纸质材料寄送至国家食品药品监督管理总局行政受理服务中心。
新技术企业、困难企业、重点企业、私营企业。
本文来源于:深圳鸿远医疗器械咨询有限公司 http://www.hongyuanyixiezixun.com 严禁转载,违者必究!
|
|
|
|
|
|