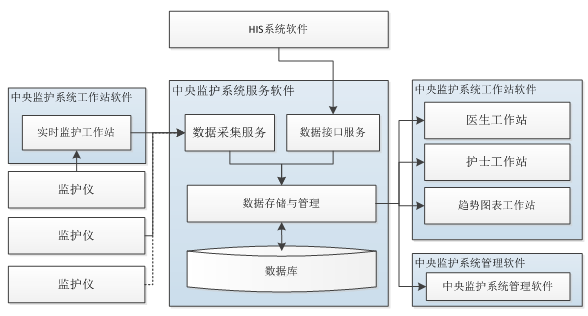
|
医疗器械注册中央监护软件产品适用的相关标准:
标准编号标准名称GB/T 25000.51—2010软件工程 软件产品质量要求与评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则
YY 0668—2008医用电气设备 第2—49部分:多参数患者监护设备安全专用要求 (51条款:危险输出的防止)
YY 0709—2009医用电气设备第 1—8 部分:安全通用要求并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南
YY 1079—2008心电监护仪(4.2.8条款:对具有心电图波形显示能力的监护仪的特殊要求)
YY/T 0316—2016医疗器械 风险管理对医疗器械的应用
YY/T 1437—2016医疗器械YY/T 0316应用指南
ISO/HL7 21731—2014 医疗信息交换标准HL7
上述标准包括了中央监护软件医疗器械产品注册所涉及到的主要标准。注册申请人可根据产品的特点引用其他行业的相关标准,比如软件工程类的标准,或信息通信类的标准和相关心电类标准。
目前国内尚无中央监护软件产品专用标准,GB/T 25000.51原则上适用,本指导原则在产品技术要求中对GB/T 25000.51第五章“COTS软件产品的要求”的符合性进行了要求。
如果中央监护软件能够判断、形成报警信息并执行报警(而不是仅从床旁监护仪获得报警信号),建议符合YY 0668—2008的51条款(危险输出的防止)。
如果中央监护软件能够显示心电波形,建议执行符合YY 1079—2008的4.2.8条款(对具有心电图波形显示能力的监护仪的特殊要求)。
医疗器械注册代理ISO/HL7 21731标准规定了医疗数据信息传输协议和标准,得到了广泛的应用,本指导推荐使用该标准,若申请人声明产品符合HL7标准,则应提供HL7符合性声明,HL7符合性声明的编写方法和内容参照HL7标准中的相关规定。
本文来源于:医疗器械软件注册 医疗器械产品注册代理
|