|
医疗器械产品注册办理申报怎么确定产品分类?
一、医疗器械分类
在我国,医疗器械按照风险程度分为三类。
第一类风险程度低,实行常规管理可以保证其安全、有效的医疗器械。仅需医疗器械备案管理。
第二类具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。需要申报医疗器械产品注册。
第三类具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。需要申报医疗器械产品注册。
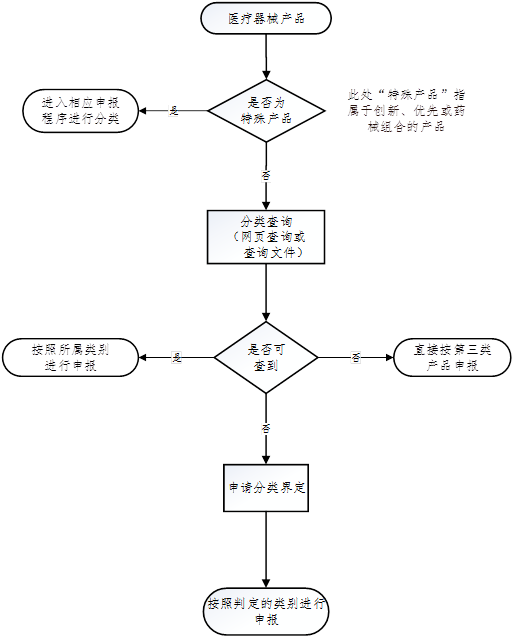
二、医疗器械类别的判定途径
1. 网页查询分类目录
进入"国家药监局网站—医疗器械"栏——点击医疗器械查询——点击医疗器械分类目录。
2. 查询文件下载《医疗器械分类规则》《医疗器械分类目录》《体外诊断试剂分类规则》《体外诊断试剂分类子目录(2013版)》《第一类医疗器械产品目录》或搜索相关分类界定文件等进行查询。
3. 申请分类界定
未列入医疗器械分类目录里的境内产品向当地省局提交申请,进口产品向医疗器械标准管理研究所提交申请。具体可参照《医疗器械分类界定申请资料填报指南》。
4. 同第三类申报
可直接按第三类医疗器械产品注册申报,器审中心根据申报产品的实际情况判定类别。
5. 创新,优先,药械组合
属于创新、优先或药械组合的产品在办理进入相应流程后,可随即进行产品类别判定。
可参考如下流程:
三、《医疗器械分类目录》相关文件汇总
新版《医疗器械分类目录》自2018年8月1日开始实施,请根据相关要求进行分类工作。
国家药监局关于发布医疗器械分类目录动态调整工作程序的公告(2021年第60号)
国家药监局关于医用透明质酸钠产品管理类别的公告(2022年第103号)
医疗器械分类界定申请资料填报指南
医疗器械分类规则(国家食品药品监督管理总局令第15号)
体外诊断试剂分类规则(2021年第129号)
总局关于发布医疗器械分类目录的公告(2017年第104号)
食品药品监管总局关于印发体外诊断试剂分类子目录的通知(食药监械管〔2013〕242号)
国家药监局关于发布第一类医疗器械产品目录的公告(2021年第158号)
关于调整《6840体外诊断试剂分类子目录(2013版)》部分内容的公告(2020年 第112号)
国家药监局关于药械组合产品注册有关事宜的通告(2021年第52号)
总局办公厅关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)
总局关于实施《医疗器械分类目录》有关事项的通告(2017年第143号)
总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(2017年第226号)
国家药监局关于实施《第一类医疗器械产品目录》有关事项的通告(2021年第107号)
《医疗器械分类目录》实施有关问题解读
《体外诊断试剂分类规则》解读
《关于药械组合产品注册有关事宜的通告》(2021年第52号)解读
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年 第147号)
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第25号)
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证、医疗器械生产许可证、进口医疗器械注册、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、医疗器械分类界定、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,老师手机及微信号:13590396780欢迎您咨询!
|