|
医疗器械注册眼底照相机产品注册综述资料要求:应描述产品主要功能、各组成部件的功能以及区别于同类产品的特征。区别于同类产品的特征是技术审评关注的重点,例如相比同类产品光源波长不同、成像方式不同、分析/测量功能不同、具有荧光成像功能、眼表成像功能或与同类产品相比视场角、分辨率等关键参数提高等特征。此外,还应在研发背景中描述产品有哪些改进,如何实现的,改进的意义是什么,解决了哪些技术问题或临床问题等。
1.工作原理
眼底照相机光学主机一般由照明系统、成像系统与观察系统三部分组成。照明系统用于将合适的光照引入眼底;成像系统用于将眼底的样貌成像于相机感测组件上;观察系统用于供操作者观察患者眼底病灶和调焦。
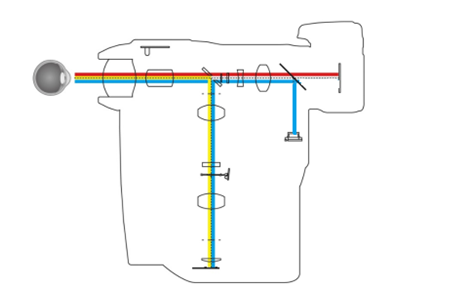
医疗器械产品注册眼底照相机一般有三个光源: 固视光源、观察照明光源与摄像闪光光源。固视光源用于引导患者聚焦凝视,观察照明光源提供长时间观察与对焦时的眼底照明,摄像闪光光源用来瞬间增加眼底照明来进行拍摄。常用的光源种类有氙灯、LED灯、卤素灯等。
医疗器械注册代理申请产品根据观察照明光源波段、成像目的的不同,眼底照相机可分为散瞳眼底照相机和免散瞳眼底照相机。
散瞳眼底照相机一般用于眼底荧光造影成像(FA)和脉络膜造影成像(ICG)检查。使用散瞳剂使患者瞳孔扩大,通过可见光的观察照明光对患者眼底进行观察和瞄准,利用可见光摄像闪光光源来拍摄、记录眼底,以供诊断各种眼底疾病。
免散瞳眼底照相机一般用于通用检查和自发荧光成像(FAF)检查。利用红外光的观察照明光和半暗室下的自然散瞳对患者眼底进行观察和瞄准,用可见光摄像闪光光源来拍摄、记录患者的眼底,以供诊断各种眼底疾病。
医疗器械产品注册代理申请产品根据观察照明光源在整个光路系统中的位置不同,可分为内部照明和外部照明两种结构,其结构示意图如图2和图3所示。
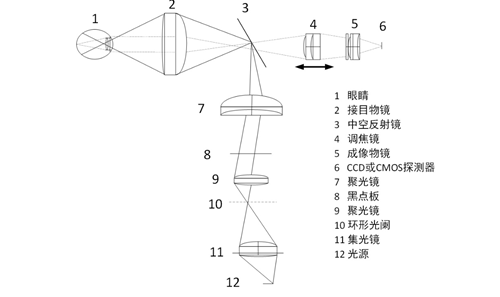
图2内部照明结构
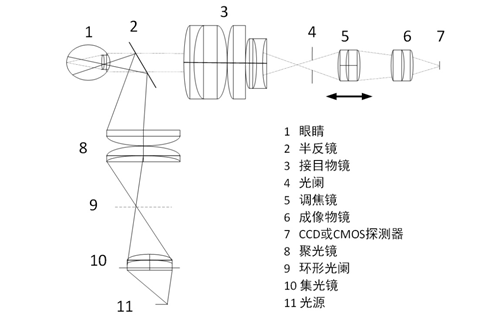
图3外部照明结构
医疗器械注册两种照明方式的结构在形式上基本相同,都由照明系统、成像系统和观察系统组成。两种结构的主要区别在于,由于观察照明光源位置的不同,外部照明方式的眼底照相机的半反镜作为照明光路和成像光路的分光元件,两组系统无共用镜组,而内部照明方式眼底照相机是用一块中空反射镜作为两光路的分光元件,两组光学系统共用接目物镜。两者相比,一般内部照明方式眼底照明亮度均匀、光能利用率高、成像清晰。
2.结构组成
医疗器械产品注册代理常见的眼底照相机有台式和手持式两种。台式眼底照相机结构组成一般包括光学主机、电源部分、颏托部分、外部固视灯(选配件)、非嵌入式独立软件(选配件)等。手持式眼底照相机结构组成一般包括光学主机、光学镜头、眼罩、电池、充电底座和电源适配器等。光学主机通常由照明系统、观察系统、成像系统等组成。嵌入式软件,不需要在结构组成中列举,但应在产品技术要求中明确软件发布版本以及版本命名规则。如含有非嵌入式独立软件,组成中应明确软件名称和发布版本。
3.主要功能
医疗器械产品注册眼底照相机可进行眼底观察、瞄准、拍摄和图像的保存等。如眼底照相机含有荧光成像(荧光造影成像FA、自发荧光成像FAF和脉络膜造影成像ICG)、去红图像、血管增强图像、脉络膜增强图像、神经纤维图像、杯盘比分析、动静脉血管对分析、大视场拼接等功能应详述各功能工作原理和临床意义。
4.预期用途和禁忌症
产品具体适用范围应与申报产品功能、临床应用范围相一致。眼底照相机的预期用途一般可限定为:产品用于拍摄眼底图像,供观察和诊断视网膜病变。
眼底照相机产品尚未发现明确的禁忌症。
5.参考的同类产品或前代产品的情况
医疗器械注册代理申请人应当提供同类产品(国内外已上市)或前代产品的信息,阐述申请注册产品的研发背景和目的。对于同类产品,应当说明选择其作为研发参考的原因。同时列表说明申请注册产品与参考产品(同类产品或前代产品)在工作原理、结构组成、性能指标以及适用范围等方面的异同。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证、医疗器械生产许可证、进口医疗器械注册、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、医疗器械分类界定、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,欢迎您咨询!
|