|
医疗器械注册证申请肢体加压理疗设备产品的说明书、标签、包装标识应当符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)及相关标准的要求,一般应包括以下内容:
1.说明书
1.1产品名称、型号、规格及其代表的意义。
1.2注册申请人的名称、住所、生产地址及联系方式。境内产品应说明生产许可证编号,进口产品还应明确代理人及售后服务单位的名称、住所、联系方式。
1.3医疗器械产品注册证书编号及产品技术要求编号。
1.4产品性能:应与产品技术要求内容一致
1.5主要结构组成:建议以实物照片/示意图加文字的形式对申报产品的整体结构进行描述,标明各主要部分的名称。如有软件,建议对软件的全部功能进行描述,并注明软件组件的名称、型号规格和发布版本。
1.6产品适用范围及禁忌症:与综述资料中描述保持一致。
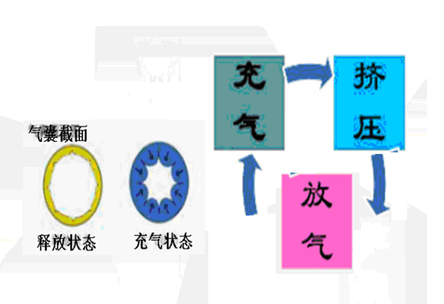
1.7医疗器械产品注册证代理注意事项、警示及提示:应按照《医疗器械说明书和标签管理规定》中第十一条的要求进行审查;同时至少应明确异常情况下的紧急处理措施;可能出现的误操作及误操作可能造成的伤害,涉及慎重使用的部分应尽可能详细清楚(如使用部位、气囊数量、充放气循环程序、治疗压力、治疗次数、持续时间等)。
1.8安装及调试:产品安装说明及技术图、线路图。若熔断器可由用户自行更换,应明确更换方法及注意事项。
1.9使用方法:应给出产品使用方法和环境条件,治疗模式的选择应详细说明。
1.10保养及维护:应给出产品维护和保养及定期检查的方法;若有可由用户自行排除的故障,则应说明故障的种类和产生的原因及排除方法等。
1.11运输条件:应根据产品环境试验情况,明确运输方法及条件。
1.12储存条件:应根据产品环境试验情况,明确储存环境要求。
1.13应明确生产日期、使用期限及在预期使用及维护条件下的定期检查时间。
1.14应明确产品配件清单,包括配件、附属品、损耗品,注明名称、更换周期以及更换方法等。
1.15医疗器械注册证办理应参照GB 9706.1-2007《医用电气设备 第1部分:安全通用要求》和YY/T 0466.1-2016《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》等相关标准中的规定,给出产品标签所用的图形、符号、缩写等内容的解释。
1.16清洁方法:医疗器械注册证申请人应根据其产品情况列出产品的清洁方法。
1.17明确说明书的编制和修订日期。
1.18医疗器械注册证代理应按照YY 0505-2012《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》的要求给出符合电磁兼容性方面要求的声明。
2.标签
产品的标签应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)和YY/T0466.1-2016《医疗器械用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》及相关标准的要求。
医疗器械产品注册证代理产品标签因位置或者大小受限而无法全部标明上述内容的,至少应当标注产品名称、型号、规格、生产日期,并在标签中明确“其他内容详见说明书”。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。专业的医疗器械注册证代理、医疗器械产品分类界定代办理、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代办理、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、电磁兼容整改、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|