|
医疗器械变更注册/变更备案办理流程?对资料什么要求?相关问题医疗器械咨询公司为大家整理相关的资料,希望能帮到大家。医疗器械变更注册/变更备案如果不知道怎么办理可以找深圳鸿远医疗器械咨询公司为您提供专业的咨询代理代办服务。
一、变更注册/备案
已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册申请人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告。
二、变更注册
1. 医疗器械注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求发生变化。
2.进口医疗器械生产地址发生变化。
3.注册证中"其他内容"发生变化。
三、医疗器械变更备案
1. 注册证中注册人名称和住所、代理人名称和住所发生变化。
2. 境内医疗器械生产地址发生变化。
四、医疗器械注册变更办理流程,医疗器械注册变更办理下证快吗?
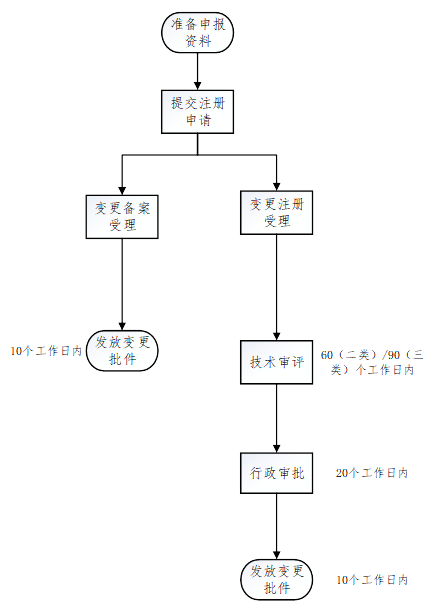
五、TIPS
对于线上途径(eRPS系统):变更备案、变更注册申请可在同一申请表申请,合并变更情形仍然按照现行流程分发变更注册受理号,自动关联变更注册电子目录,在进口医疗器械/体外诊断试剂变更注册电子目录的"CH2.7其他申报综述信息"中体现变更备案需提交的资料。
对于线下途径:变更备案、变更注册申请须分别填表,分别准备材料,同时准备符合《关于发布医疗器械注册电子申报目录文件夹结构的通告(2021年第15号)》要求的电子资料。
医疗器械变更注册文件与原医疗器械注册证合并使用,其有效期与原注册证相同。
取得变更注册文件后,注册人应当根据变更内容自行修改产品技术要求、说明书和标签。
发生其他变化的,注册人应当按照质量管理体系要求做好相关工作,并按照规定向药品监督管理部门报告。
变更事项不可与延续注册合并提出申请。
医疗器械变更注册/变更备案办理流程?对资料什么要求?如果您还不清楚怎么办理可以找医疗器械注册咨询公司协助您办理。
医疗器械注册代理找深圳鸿远医疗器械咨询有限公司提供专业的辅导办理服务。
|